| 2003年12月 3日
更新日:2004年 2月16日 |
||
|
||
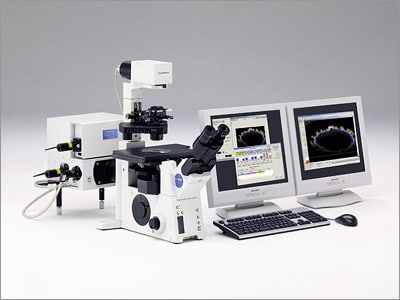 |
| 共焦点レーザ走査型顕微鏡「FLUOVIEW FV1000」
倒立顕微鏡「IX81」との組み合わせ例 |
| オリンパス株式会社(社長:菊川 剛)は、世界で初めてツインスキャンシステムを搭載した共焦点レーザ走査型顕微鏡「FLUOVIEW FV1000」を分子生物学を研究する大学・研究機関や創薬メーカー向けに2004年1月25日から日本で発売し順次全世界へ展開します。新機能の1つとして世界初のツインスキャンシステムを搭載することで、生きた細胞へのレーザによる光刺激とその反応の同時観察を可能にしました。これにより、細胞内物質の振る舞いの詳細な経過観察を実現し、細胞機能解明の研究ニーズに応えます。 | ||||||||||||
|
||||||||||||
| 尚、共焦点レーザ走査型顕微鏡「FLUOVIEW FV1000」は12月10日(水)から13日(土)まで神戸国際展示場で開催される第26回日本分子生物学会年会(年会長 岡崎国立共同研究機構 基礎生物学研究所 所長 勝木 元也)で出展いたします。 | ||||||||||||
| 発売の概要 | |||||
|
|||||
| 主な特徴 | ||||||||||||
|
||||||||||||
|
||||||||||||
| 市場導入の背景 |
| 生命科学の研究はゲノムから生きた細胞へと研究の対象が変わってきました。それらの研究では生きた細胞内での遺伝子やタンパク質の機能を解析するために、遺伝子工学的手法で細胞に忍び込ませた蛍光を読み取りそれを画像化して解析するという、いわゆる蛍光イメージングが多く用いられるようになりました。そしてこの方法により病気のメカニズムを細胞レベルで解析する研究が盛んに行われています。今回発売する「FLUOVIEW FV1000」は従来機の約4年ぶりのフルモデルチェンジであり、世界初のツインスキャンシステムの搭載に加え、細胞内の複数の場所の同時観察や、分解能、明るさのアップなど様々なニーズに応えるために開発されました。これからますます拡大するバイオの市場に向けて、今回の「FLUOVIEW FV1000」投入を皮切りに、当社のゲノム事業とのシナジーにより、細胞機能解明の研究ニーズに応えていきます。 |
| 主な特徴の詳細 | ||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
| 関連リンク | ||
|
||
|
||
オリンパス光学工業株式会社は、2003年10月1日をもってオリンパス株式会社と社名変更いたしました。
- 本リリースに掲載されている内容は、報道関係者向けに発表した情報です。
- 掲載内容は、発表日現在の情報であり、ご覧になっている時点で、予告なく情報が変更(生産・販売の終了、仕様、価格の変更等)されている場合があります。
- 掲載されている社名、製品名、技術名は各社の商標または登録商標です。
本文の終わりです

